- タンパク質のO-GlcNAc化
タンパク質のO-結合型N-アセチルグルコサミン(O-GlcNAc)化は、タンパク質のセリン(Ser)あるいはトレオニン(Thr)残基の水酸基に対してGlcNAcが一つだけ付加される酵素的翻訳後修飾の一つです。ウリジン二リン酸-N-アセチルグルコサミン(UDP-GlcNAc)を糖供与体としてO-GlcNAc転移酵素 (OGT)により付加され、 β-D-N-アセチルグルコサミニダーゼ(OGA)により脱離されます。
UDP-GlcNAc はヘキソサミン生合成経路を介したグルコースの最終代謝物です。よって、グルコースが増加するとUDP-GlcNAcが増加し、その結果タンパク質のO-GlcNAc化修飾が増加します(図1)。近年、O-GlcNAc化はシグナル伝達(リン酸化と拮抗)、エピジェネティック制御、転写、分解、ストレス応答など様々な生物学的プロセスに関与し、糖尿病、がん、神経変性疾患などの病態においても重要な役割を果たしている翻訳後修飾であることが明らかになってきました。
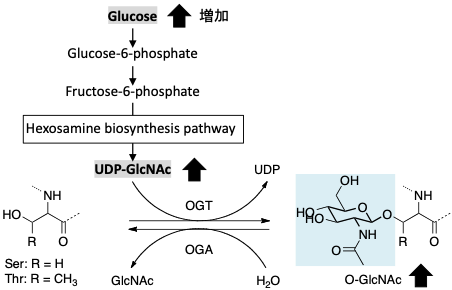
図1
- O-GlcNAc化タンパク質の解析
O-GlcNAc化の役割を分子レベルで理解するためには、修飾されるタンパク質、修飾部位、変動も明らかにする必要があります。しかしながら、微量なO-GlcNAc化タンパク質の網羅的解析は容易ではなく、高感度な分析法の開発が望まれています。
近年ではO-GlcNAc化タンパク質の解析に酵素反応とクリック反応が利用されるようになってきました。アジド基を有する非天然型UDP-Gal(UDP-GalNAz)と糖転移酵素変異体Gal-T1(Y289L)を用いて O-GlcNAc化部位にアジドを導入した後、特異的かつ高収率なアジドとアルキンのクリック反応により“濃縮用のタグ”としてビオチンなどを導入する方法です。
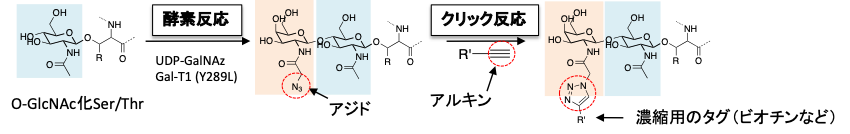 図2
図2
- O-GlcNAc化ペプチド濃縮法の開発
我々はこれまで可逆的共有結合であるジスルフィド結合を利用した新規O-GlcNAc化ペプチド濃縮法を開発しました。本濃縮法は、酵素反応によりO-GlcNAc化部位へアジドを導入した後、独自に設計・合成したチオール−アルキン1を用いてクリック反応によりチオール(-SH)を導入します。このチオールにより、ジスルフィド結合(-SS-)を介して樹脂へ固定化することが可能になりました(図3)。共有結合であるため変性剤、界面活性剤、有機溶媒、酸などによる十分な洗浄が可能であり、非特異的吸着を軽減できると期待できます。また、ジスルフィド結合は還元剤により温和な条件下で容易に切断できる利点もあります。さらに、誘導体化されたO-GlcNAc化部位はLC-MS/MSにおいて特徴的なフラグメントイオンを生じ、O-GlcNAc化ペプチドであることを判定する有用な診断イオンとして利用できる特徴があります。
 図3
図3
今後、独自に開発した分析手法を用いて糖尿病モデル動物やヒトの組織を解析し、糖尿病におけるO-GlcNAc化の役割を明らかにしていきたいと考えています。
- 関連論文
- Tsumoto, H., Akimoto, Y., Endo, T., Miura, Y. Med. Chem. Lett., 2017, 27, 5022-5026. doi: 10.1016/j.bmcl.2017.10.005.
- Tsumoto, H., Ogasawara, D., Hashii, N., Suzuki, T., Akimoto, Y., Endo, T., Miura, Y. Med. Chem. Lett., 2015, 25, 2645-2649. doi: 10.1016/j.bmcl.2015.04.082.